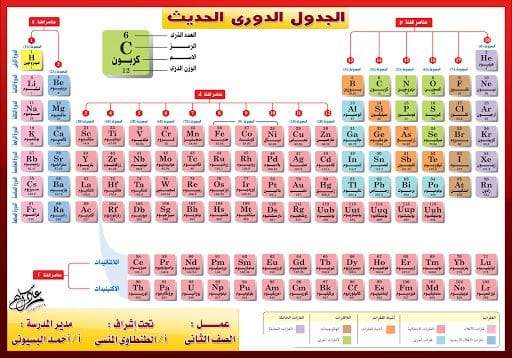
الجدول الدوري للعناصر يتم تعريفه على أنه مصفوفة منظمة لجميع العناصر الكيميائية بناء على ازدياد أعدادها الذرية أي عدد البروتونات الكلي في النواة الذرية والتوزيع الإلكتروني والخواص الكيميائية المتكررة، وتكون هذه العناصر مرتبة في هذا الجدول حسب زيادة عددها الذري من اليسار إلى اليمين، ومن الأعلى إلى الأسفل، وتعرف مجموعة العناصر الموجودة ضمن الصف الواحد في الجدول الدوري بالدورة، في حين يطلق على مجموعة العناصر التي تنتمي إلى نفس العمود اسم المجموعة، وتجدر الإشارة إلى أنه تعود بداية اكتشاف الجدول الدوري إلى منتصف القرن التاسع عشر من قِبل العالم ديميتري مندليف.
أهمية الجدول الدوري

يعتبر الجدول الدوري أحد أهم الأدوات التي تم اكتشافها في تاريخ علم الكيمياء ولهذا الجدول أهمية كبيرة بالنسبة لمن يستخدمه، وسوف نستعرض معا بعضا من الأمور التي تشير إلى أهمية هذا الجدول:
تصنيف العناصر: يقوم الجدول الدوري بتصنيف العناصر جميعها ضمن مجموعات أفقية ورأسية وذلك حسب تشابه الخصائص لهذه العناصر، لهذا السبب يعتبر هذا الجدول مرجعا سريعا للتعرف على العناصر الكيميائية التي لها نفس الخصائص،
التجارب المبينة على الخصائص: يتيح هذا الجدول للأشخاص إجراء تجارب علمية قائمة على معرفة العناصر وخصائصها، فمن خلال الجدول يمكن الحدس بخواص عنصر ما، وكيفية التفاعل مع عنصر آخر. فلو أراد دارس معرفة خواص عنصر كالفرانسيوم francium مثلا، فيمكنه التعرف عليه من خلال خواص المجموعة 1، فسيعرف أنه معدن لين يتفاعل بشدة مع الماء أكثر من العنصر الذي فوقه.
التعرف على العناصر: يتيح الجدول الدوري معرفة العناصر الكيميائية بشكل دقيق، حيث أصبح لكل عنصر رمزه الكيميائي، فالكربون رمزه C والأكسجين رمزه O والكبريت رمزه S والهيدروجين رمزه H.
خصائص الجدول الدوري
تتمتع عناصر الجدول الدوري بالعديد من الخصائص، ومنها ما يأتي:
- يوجد في الجدول الدوري 118 عنصر، ولا زال البحث قائماً عن ابتكار وإيجاد عناصر جديدة.
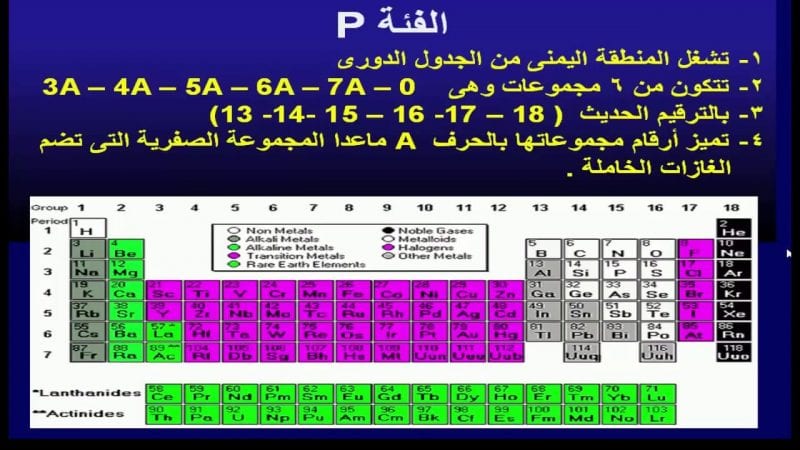
- معظم العناصر في الجدول الدوري عبارة عن معادن، وهي المعادن القلوية، والمعادن القلوية الترابية، والمعادن الأساسية، والمعادن الانتقالية.
- يحتوي الجدول الدوري على سبع دورات أفقية كما يحتوي على 18 مجموعة (الأعمدة الرأسية).
- يطلق على اسم صفوف الجدول (الدورات)، ويكون رقم عنصر الدورة، عبارة عن أعلى مستوى طاقة، للإلكترونات غير المهيجة.
- يعتمد الجدول الدوري في تصنيف العناصر، على الزيادة في أعدادها الذرية، حيث يقل حجم الذرة، عند الانتقال من اليسار إلى اليمين في الدورة الواحدة، كما يزداد عند الانتقال من أعلى إلى أسفل المجموعة الواحدة.
- عناصر المجموعة الواحدة متشابهة في الخصائص، ولها نفس ترتيب إلكترونات المدار الأخير.
- عناصر المجموعة الأولى والثانية والثالثة تميل لفقد الإلكترونات، وتصبح أكثر كهروموجبية، كما أن عناصر المجموعة الرابعة والخامسة والسادسة تميل لكسب الإلكترونات، وتصبح أكثر كهروسالبية.
- تنتهي كل دورة في الجدول بعنصر خامل (نبيل)، يتميز بأن إلكترونات مداره الأخير ممتلئة.
- إلكترونات التكافؤ، أو إلكترونات المدار الأخير للعنصر، تحدد رقم الدورة التي ينتمي إليها.
- تقع في أسفل الجدول الدوري سلسلتان طويلتان من العناصر، تسمى السلسلة الأولى اللانثنيدات والسلسلة الثانية الأكتنيدات، وتحتوي كل سلسلة على 14 عنصرا، وتنتمي هذه السلاسل إلى مجموعة العناصر الانتقالية، وقد وضعت في أسفل الجدول لتوفير الحيز.
- تصنف العناصر في الجدول إلى فلزات ولا فلزات، يقسم بينهما أشباه الفلزات.
- تقل الكهروسالبية كلما انتقلنا من يمين إلى يسار العناصر في الجدول.
أسماء عناصر الجدول الدوري
يتكون الجدول الدوري من مجموعة من العناصر الكيميائية حيث يضم الجدول الحالي 118 عنصرا كيميائيا، وفيما يأتي قائمة بأسماء عناصر الجدول الدوري باللغة العربية:
- الهيدروجين (H).
- الهيليوم (He).
- الليثيوم (Li).
- البريليوم (Be).
- البورون (B).
- الكربون (C).
- النيتروجين (N).
- الأوكسجين (O).
- الفلورين (F).
- نيون (Ne).
- الصوديوم (Na ).
- المغنيسيوم (Mg).
- الألمنيوم (Al).
- السيليكون (Si).
- الفوسفور (P).
- الكلور (Cl).
- الكبريت (S).
- أرغون (Ar).
- البوتاسيوم (K).
- الكالسيوم (Ca).
- السكانديوم (Sc).
- التيتانيوم (Ti).
- الفاناديوم (V).
- الكروم (Cr).
- المنغنيز (Mn).
- الحديد (Fe ).
- الكوبالت (Co).
- النيكل (Ni).
- النحاس (Cu).
- الزنك (Zn).
- الغاليوم (Ga).
- جيرمانيوم (Ge).
- الزرنيخ (As).
- سيلينيوم (Se).
- البروم (Br).
- الكريبتون (Kr).
- الروبيديوم (Rb).
- سترونشيوم (Sr).
- الأتريوم(Y).
- زركونيوم (Zr).
- النيوبيوم (Nb).
- موليبدنوم (Mo).
- تكنيشيوم (Tc).
- الروثينيوم (Ru).
- الروديوم (Rh).
- بالاديوم (Pd).
- الفضة (Ag).
- كادميوم ( Cd).
- الإنديوم (In).
- القصدير (Sn).
- إثمد (Sb).
- تيلوريوم (Te).
- يود (I).
- زينون (Xe).
- سيزيوم (Cs).
- لانثانوم (Ba).
- سيريوم (La).
- السيريوم (Ce).
- براسوديميوم (Pr).
- نيوديميوم (Nd).
- بروميثيوم (Pm).
- ساماريوم (Sm).
- يوروبيوم (Eu).
- الغادولينيوم (Gd).
- التربيوم (Tb).
- ديسبروسيوم (Dy).
- هولميوم (Ho).
- إربيوم (Er).
- توليوم (Tm).
- إتيربيوم (Yb).
- لوتيشيوم (Lu).
- هافنيوم (Hf).
- تانتالوم (Ta).
- تنجستن (W).
- رينيوم (Re).
- أوزميوم (Os).
- إريديوم (Ir).
- بلاتين (Pt).
- ذهب (Au).
- الزئبق (Hg).
- ثاليوم (Ti).
- رصاص (Pb).
- بزموت (Bi).
- بولونيوم (Po).
- أستاتين (At).
- راديون (Rn).
- فرانسيوم (Fr).
- راديوم (Ra).
- أكتينيوم (Ac).
- ثوريوم (Th).
- بروتكتينيوم (Pa).
- يورانيوم (U).
- نبتونيوم (Np).
- بلوتونيوم (Pu).
- أمريسيوم (Am).
- كوريوم (Cm).
- بركيليوم (Bk).
- كاليفورنيوم (Cf).
- أينشتاينيوم (Es).
- فرميوم (Fm).
- مندليفيوم (Md).
- نوبليوم (No).
- لورنسيوم (Lr).
- رذرفورديوم (Rf).
- دوبنيوم (Db).
- سيبورغيوم (Sg).
- بوريوم (Bh).
- هاسيوم (Hs).
- مايتنريوم (Mt).
- دارمشتاتيوم (Ds).
- رونتيجينيوم (Rg).
- كوبرنيسيوم (Cn).
- نيهونيوم “أنون تريوم” (NH).
- فليروفيوم (Fl).
- موسكوفيوم (Mc).
- ليفرموريوم (LV ).
- تينيسين (TS).
- أوغانيسون (og).